Atskleista ŽIV uždanga (0)
ŽIV-1, virusas, sukeliantis AIDS, garsėja savo sugebėjimu išsisukti nuo imuninės sistemos. Naujas tyrimas rodo, kad šis landumo talentas priklauso nuo kapsidės baltymo, sudarančio viruso išorinį dangalą.
Xavieras Lahaye'is ir Takeshi'is Satoh'o iš Curie instituto Paryžiuje atrado, kad ŽIV-1 kapsidė paslepia savo DNR nuo dendritinių ląstelių – sargų, aptinkančių kylančias grėsmes ir mobilizuojančių imuninę sistemą. Tyrėjams taip pat pavyko pakelti šią imuniteto uždangą, pakeičiant kapsidę.
|
Visi šio ciklo įrašai |
|
Prisijunk prie technologijos.lt komandos!
Laisvas grafikas, uždarbis, daug įdomių veiklų. Patirtis nebūtina, reikia tik entuziazmo.
Sudomino? Užpildyk šią anketą!
„Žaisdami su kapside, sukūrėme ŽIV-1, kuris nesidaugina, bet gali stimuliuoti imuninį atsaką,“ sakė tyrimui vadovavęs Nicolas Manel. „Įsivaizduojame, kad galėtume pakeisti virusą ir naudoti jį kaip vakciną.“ Rezultatai publikuoti šiandien žurnale Immunity.
„Tai labai gražus darbas,“ pažymėjo Gregas Towersas iš UCL, kuris nebuvo susijęs su tyrimu, bet neseniai publikavo panašius rezultatus. „Manau, visi esame tame pačiame puslapyje, ir vyksta paradigmos poslinkis mūsų supratime, kaip ŽIV sąveikauja su imunine sistema. Anksčiau manėme, kad kapsidė iš viruso pasišalindavo, kai šis jau būdavo ląstelėje, ir jos darbas būdavo baigtas. Pasirodo, ji dar ir saugo viruso DNR nuo aptikimo.“
Dendritinės ląstelės gali atpažinti jas užkrečiančius virusus įvairiomis sensorinėmis molekulėmis, ir jos liepia kitoms imuninės sistemos dalims puti šias grėsmes. „Jos yra pagrindiniai imuninio atsako dirigentai,“ sako Manelis. „Jie pirmieji aptinka patogenus ir nurodo tolesnius veiksmus.“
2010 m. Manelio komanda parodė, kad dendritinės ląstelės tam tikromis aplinkybėmis gali aptikti ŽIV-1, nors tai ir netipiška, kadangi virusai paprastai ląstelių efektyviai neužkrečia. Tuo tarpu giminingas virusas ŽIV-2 visiškai užkrečia dendritines ląsteles ir sukelia stiprų imuninį atsaką. Tai iš dalies paaiškina, kodėl ŽIV-1 gali išvengti imuninės sistemos ir sukelti AIDS, kai tuo tarpu ŽIV-2 to nesugeba.
Komanda norėjo išsiaiškinti, kaip dendritinės ląstelės aptinka virusus ir kurias dalis junta. Jie pradėjo nuo ŽIV-2 kapsidės keitimo ir išsiaiškino, kad pakeitus vienintelę aminorūgštį, gautas virusas nebegalėjo užkrėsti dendritinių ląstelių, tačiau virusą jos aptikti galėjo. Tai rodė, kad aptikimas vyksta ankstyvoje viruso gyvenimo ciklo fazėje, dar prieš atsirandant progai sukurti savo kopijas.
Vos tik ŽIV-1 ir ŽIV-2 atsiduria ląstelėje, jie nukopijuoja savo RNR genomą į DNR molekulę, kuri integruota į šeimininko genetinę medžiagą. Komanda išsiaiškino, kad būtent šią DNR dendritinės ląstelės ir aptinka. „Aptikimui reikia DNR sintezės, tačiau kiti žingsniai nebereikalingi,“ sakė Manelis.
Tyrėjai taip pat identifikavo ir sensorinę molekulę – baltymą cGAS, kurią šiais metais atrado Teksaso universiteto Šiaurės vakarų medicinos centro Dallase mokslininkai. Kai cGAS aptinka viruso DNR dendritinėse ląstelėse, jis paleidžia molekulinių signalų grandinę, vadovaujančią imuniniam atsakui.
Tai paaiškina ŽIV-2, bet kaip ŽIV-1 išvengia aptikimo? Komanda parodė, jog kapsidė kažkaip maskuoja viruso DNR nuo cGAS. Taip DNR gali integruotis į nešiotojo genomą, būti nukopijuota ir pagaminti naujus virusus.
Komandai pavyko nuvilkti nematomumo gobtuvą, mutuojant kapsidę ir taip paliekant ŽIV-1 DNR atvirą ir matomą cGAS sensoriams. Tai sukėlė mintį, kad panašiai modifikuoti virusai, po ilgo vystymo, gali tapti vakcinos pagrindu. Ši modifikacija tam tikru lygiu vyksta ir natūraliai – ŽIV-1 nešiotojai gyvena ilgiau ir turi mažesnę tikimybę susirgti AIDS, jei anksčiau buvo užsikrėtę ŽIV-2.
Be to, „galime pagalvoti apie mažus cheminius komponentus, stimuliuojančius tokią eigą ir mėgdžiojančius imuninį atsaką,“ sakė Manelis.
„Tyrimas pabrėžia ŽIV-2 tyrinėjimo svarbą [siekiant pagerinti] mūsų supratimą apie ŽIV-1 patogenezei svarbius mechanizmus,“ el. laiške pridūrė Joakimas Esbjörnssonas iš Lundo universiteto.
X. Lahaye et al., „The capsids of HIV-1 and HIV-2 determine immune detection of the viral cDNR by the innate sensor cGAS in dendritic cells,“ Immunity, doi:10.1016/j.immuni.2013.11.002, 2013.
Ed Yong
www.the-scientist.com
ŽIV nuginklavimas
Efektyvaus būdo, užkertančio kelią AIDS sukėlėjui, žmogaus imunodeficito virusui, radimas seniai buvo iššūkis mokslininkams ir gydytojams, nes virusas dažnai mutuoja ir dėl to greitai tampa atsparus medikamentams. Drexelio universiteto tyrėjai stengiasi aplenkti virusą vienu žingsniu savo sukurtu mikrobicidu, įtikinančiu ŽIV šokti į nebūtį.
Šis preparatas vadinasi DAVEI – Dual Action Virolytic Entry Inhibitor (dvigubo veikimo virolitinis įsiskverbimo inhibitorius) – ir jis gali apgauti ŽIV. DAVEI išrado ir išbandė Drexelio inžinerijos koledžo, Biomedicinos inžinerijos mokyklos, Mokslo ir sveikatos sistemų, bei Medicinos koledžo mokslininkai, ir tai naujausios kartos ŽIV vaistas, specifiškai naikinantis virusus ir nekenkiantis sveikoms ląstelėms.
„Nors buvo pranešta apie kelias ŽIV naikinančias molekules, DAVEI yra unikalus preparatas savo veikimo principu, specifiškumu ir didelėmis galimybėmis,“ sakė Dr. Cameronas Abramsas, Drexelio inžinerijos koledžo profesorius ir pagrindinis projekto tyrėjas.
Abramso ir Dr. Irwino Chaikeno bendrai vadovaujama Drexelio medicinos koledžo Biochemijos ir molekulinės biologijos departmento komanda, kartu su biomedicinos doktorantais Arangassery Rosemary Bastian ir R. V. Kalyana Sundaram, ir Dr. Marku Contarino, Drexelio biomedicinos inžinerijos mokyklos, Mokslo ir sveikatos sistemų absolventais, sukūrė chimerišką rekombinantinį baltymą – tai yra, molekulę, surinktą kitų molekulių gabalų ir pakeistą konkrečiam tikslui, šiuo atveju – kovai su ŽIV. Jų tyrimai bus paskelbti [jau paskelbti - red.] American Society for Microbiology’s Antimicrobial Agents ir Chemotherapy. spalio numeryje
DAVEI atsiradimą paskatino idėja sukurti molekulę, užgrobiančią viruso susiliejimo mašineriją, – įrankius, kuriuos jis naudoja prisitvirtinimui prie sveikų ląstelių ir jų užpuolimui, ir apgauti virusą, kad jis susinaikintų pats. ŽIV įsiveržia į sveiką ląstelę iš pradžių prisitvirtindamas baltymų „smaigais“, kurie paskui susitraukia, suliesdami viruso ir ląstelės membranas, jas suliedami ir leisdami genetiniam viruso turiniui atsidurti sveikoje ląstelėje. Tada tokia ląstelė viruso genetine medžiaga pakeičiama taip, kad ši ima gaminti virusus, užuot atlikusi savo įprastines funkcijas, kas ŽIV užkrėstų ląstelių atveju reiškia imuniteto praradimą. To rezultatas – AIDS.
„Iškėlėme hipotezę, kad svarbi susiliejimo mechanizmo užduotis yra tinkamu metu atverti viruso membraną, o iš čia išplaukia, kad veikimą nebūtinai turi aktyvuoti pasmerktoji ląstelė,“ aiškina Abramsas. „Taigi, išsiaiškinome, kaip konkretūs viruso susiliejimo mechanizmo komponentai veikia ir sukūrėme molekulę, kuri suaktyvintų jį prieš laiką,“ tęsia jis.
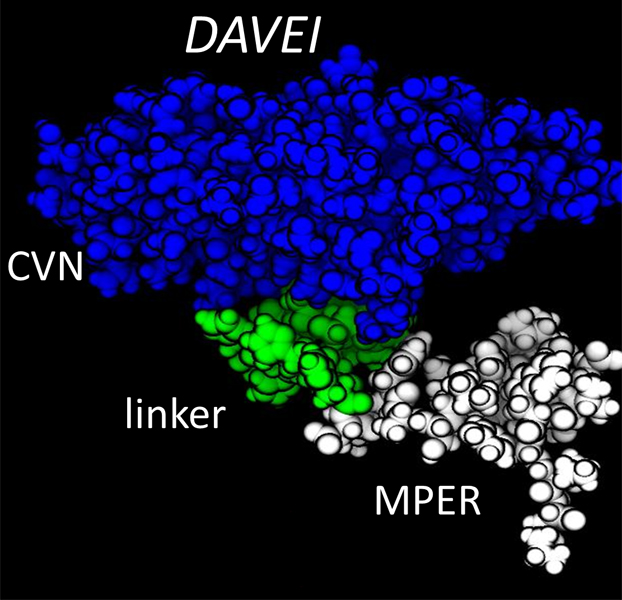
Komanda sukūrė DAVEI iš dviejų pagrindinių ingredientų. Vienas, vadinamas membranos artimu išoriniu regionu (Membrane Proximal External Region – MPER), pats yra mažas susiliejimo mechanizmo gabalėlis ir stipriai sąveikauja su viruso membranomis. Kita dalis, cianovirinas, prisijungia prie baltyminio smaigo cukraus paviršiaus. Veikdami kartu, MPER ir cianovirinas DAVEI preparate „pajudina“ susiliejimo mechanizmą taip, kad veikiančios jėgos pamėgdžioja veikiančias, prisijungiant prie ląstelės.
„Galima sakyti, DAVEI „apgauna“ virusą ir šis ima „manyti“, kad apkrečia sveiką ląstelę, kai iš tiesų nėra nieko, ką jis galėtų apkrėsti,“ dėsto Abramsas. „Tad jis paleidžia savo genetinį užtaisą nepadarydamas žalos ir žūva.“
Chaikeno laboratorija nuodugniai tyrė ŽIV-1 gaubiančio baltymo sąveikos su ŽIV naikinančiomis medžiagomis molekulinius mechanizmus ir struktūrą. Tyrėjai pagamino DAVEI, naudodami rekombinantinę baltymų inžineriją ir su ŽIV-1 pseudovirusais pademonstravo, kad preparatas gali fiziškai suplėšyti ir negrįžtamai deaktyvuoti virusų daleles.
„DAVEI ir kiti naujos kartos virolitiniai deaktyvatoriai suteikia svarbią progą sukurti vietinį mikrobicidą ŽIV perdavimo blokavimui, ir tuo pat metu atrasti jau užsikrėtusių žmonių gydymo strategijas,“ pažymėjo Chaikenas. „Tikimės, kad inhibitorių ir virusų patekimo į ląstelę struktūrinių varomųjų jėgų nustatymas, leidžiantis deaktyvuoti smaigus, padės patobulinti molekulių dizainą, suteiks joms didesnę galią, specifiškumą bei klinikinį potencialą ir prevencijai, ir gydymui.“